Феномен прекондиционирования
Феномен прекондиционирования
Донецкий государственный медицинский университет им. М.Горького
Институт неотложной и восстановительной хирургии им. В.К.Гусака АМН Украины, г.Донецк
Н.Т.Ватутин и соавторы…
В обзоре представлены современные данные литературы о механизмах ишемического прекондиционирования в норме и при патологических состояниях (дислипидемия, атеросклероз, ожирение, метаболический синдром, сахарный диабет, артериальная гипертензия). Рассмотрены вопросы влияния возраста и физических нагрузок на защиту миокарда от ишемического повреждения. Отдельно отмечены препараты, обладающие свойствами индукторов ишемического прекондиционирования. Приведены данные о положительном влиянии данного феномена на стволовые клетки.
Ключевые слова: ишемическое прекондиционирование
Несмотря на определённые успехи в профилактике и лечении ишемической болезни сердца (ИБС), это заболевание, по-прежнему, остаётся одной из основных причин утраты трудоспособности и смертности населения экономически развитых стран мира. В связи с этим продолжается поиск новых подходов в борьбе с этой патологией. Одним из перспективных методов предупреждения и лечения ишемических кардиальных катастроф может стать эндогенная кардиопротекция и, в частности, ишемическое прекондиционирование [49].
Прекондиционирование — это метаболическая адаптация миокарда к ишемии, развивающаяся после повторяющихся кратковременных эпизодов снижения доставки кислорода тканям миокарда и приводящая к повышению устойчивости мышцы сердца к последующей более длительной ишемической атаке. Согласно данным литературы [17] повышение устойчивости кардиомиоцитов в условиях развития прекондиционирования позволяет снизить вероятность развития инфаркта миокарда (ИМ), а при его возникновении обеспечивает меньшие размеры зоны некроза, уменьшает вероятность появления аритмий, в том числе и реперфузионных, предупреждает значительные нарушения функции левого желудочка (ЛЖ).
История
Впервые феномен ишемического прекондиционирования был обнаружен R. Lange et al. (1984) [37], которые в эксперименте показали, что содержание аденозинтрифосфата (АТФ) в миокарде после повторных коротких периодов ишемии снижается в меньшей степени, чем при однократном эпизоде. В 1986 г. C.E. Murry et al. [49] описали влияние предшествующей преходящей ишемии (продолжительностью 5 мин) на течение ИМ. В частности, было отмечено, что размер зоны некроза миокарда при последующей окклюзии коронарной артерии экспериментального животного (собаки) был на 25% меньше по сравнению с группой контроля. Для обозначения этого феномена авторы предложили использовать термин «ишемическое прекондиционирование».
В 1991 г. G.S. Liu et al. [12] установили, что для активации ишемического прекондиционирования необходима стимуляция аденозиновых рецепторов А1, а использование их антагонистов блокирует его запуск. Так был обнаружен один из основных триггеров этого процесса — аденозин. Позднее были открыты два других механизма запуска ишемического прекондиционирования — с участием брадикинина и опиоидов [75].
Приступ стенокардии не только является симптомом ИБС, но и является важным сигналом для пациента и лечащего врача об эпизоде кратковременной ишемии миокарда. При непродолжительной приступе стенокардии также может развиваться ишемическое прекондиционирование миокарда. В подтверждение сказанному интересные данные были выявлены в процессе субанализа результатов клинического исследования TIMI-4 (1995) [35], показавшем, что пациенты, страдавшие стенокардией до развития ИМ, имели меньшие размеры зоны некроза и более благоприятный клинический исход заболевания. В частности, частота развития тяжелой сердечной недостаточности (СН) или кардиогенного шока у них составляла 1%, в то время как в контрольной группе (без признаков стенокардии до ИМ) — 7% (р=0,006). Эти данные были подтверждены и в исследовании TIMI-9B (1998) [17], в котором у пациентов с предшествующей стенокардией было меньше сердечно-сосудистых событий в первые 30 сут после развития ИМ и отмечалась тенденция к более низкому уровню креатинфосфокиназы (КФК) в плазме крови по сравнению с контрольной группой. В дальнейшем и другие клинические исследования [14,28,67] подтвердили благоприятное влияние предшествующей ИМ стенокардии на тяжесть его течения.
Механизмы прекондиционирования
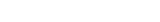
Согласно современным представлениям [17,79] весь процесс прекондиционирования делится на три последовательных этапа: восприятие стимула (триггерный), его передача ферментами-медиаторами (сигнальный) и воздействие на клеточные мишени, ответственные за защиту миокарда (эффекторный). В основе первого этапа лежит накопление в сердечной мышце под воздействием коротких последовательных эпизодов ишемии определённых веществ-триггеров [23,32,75].Эти триггеры делятся на две группы: рецептор-зависимые и независимые. К первой группе относят вещества (опиоиды, норадреналин, аденозин, брадикинин и др.), инициирующие процесс путём активации специфических рецепторов на мембране кардиомиоцитов, ко второй (активные формы кислорода (АФК), ионы кальция, оксид азота и др.), воздействующие на эндотелий, ионные каналы мембран клеток сердца и сосудов. По происхождению триггеры могут быть эндогенными и экзогенными (табл.).
Наиболее подробно изучены механизмы прекондиционирования, запускаемые рецептор-зависимыми триггерами. Передача сигнала от рецепторов к клеточным мишеням кардиопротекции осуществляется системой медиаторов ферментативной природы, к которым относятся протеинкиназа С,
Таблица. Классификация триггеров ишемического прекондиционирования
Примечания:
IL-1B — интерлейкин-1B,
IL-2— интерлейкин-2
TNF—α — фактор некроза опухоли- α
АФК — активные формы кислорода
КАТФ — АТФ-зависимые калиевые каналы
тирозинкиназа, митоген-активирующая протеинкиназа, киназа, регулируемая внеклеточными сигналами, фосфатидилинозитол-3-киназа и прочие [19,58]. Две последние, так называемые RISK-киназы, согласно данным литературы [61], играют важную роль в снижении реперфузинного повреждения миокарда.
Следующим этапом механизма прекондиционирования является активация белков эффекторов, а именно митохондриальных и сарколеммальных КАТФ-каналов, NO-синтазы [13,68]. Следствием такой активации являются открытие КАТФ-каналов сарколеммы и митохондрий клеток миокарда, предотвращение чрезмерного образования АФК, препятствование открытию специфических ионных каналов внутренней мембраны митохондрий, оптимизация метаболизма жирных кислот.
Всё вышеперечисленное в итоге приводит к: 1) ослаблению внутриклеточной, в т.ч. и внутримитохондриальной перегрузки ионами Са2+; 2) снижению сократительной способности миокарда и, соответственно его, потребности в энергии; 3) стимулированию образования необходимого количества АФК и уменьшению выраженности оксидативного стресса; 4) предотвращению отёка матрикса митохондрий; 5) оптимизации синтеза АТФ; 6) замедлению процесса апоптоза; 7) стабилизации структуры мембран кардиомиоцитов (рис.).
Следует отдельно отметить роль АФК в процессе передачи и реализации ферментно- медиаторного сигнала. Образующиеся в умеренных количествах свободные радикалы могут служить как триггерами, так и эффекторами в процессе прекондиционирования. Однако избыточное их образование является губительным и приводит к оксидативному стрессу и повреждению миокарда [46]. Имеются также сведения об участии в изучаемом эффекте белков теплового шока [41,74], СО [36], ионов хлора [16], железа [11] и прочих биологически активных веществ, выступающих в роли конечных звеньев прекондиционирования.
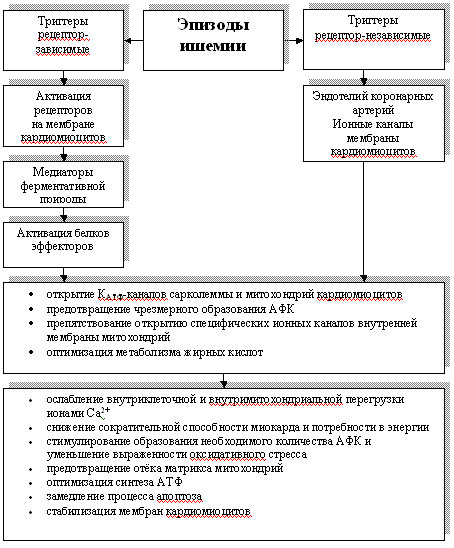
Рисунок. Механизмы прекондиционирования
Ранее полагали [49], что кардиопротективный эффект ишемического прекондиционирования проявляется немедленно после очередного эпизода ишемии и затем через 1-2 ч ослабевает. Однако позже было показано [54], что через 12-24 ч он возобновляется и продолжается до 72 ч (хотя и в менее выраженной форме). Эта поздняя (отдаленная) фаза сопротивления ишемическому повреждению миокарда получила название «второго окна защиты» (second window of protection — SWOP).
Прекондиционирование и возраст
Результаты некоторых исследований [44,56] показали, что между возрастом и способностью миокарда адекватно реагировать на прекондиционирование существует определённая зависимость.
В эксперименте на крысах [52] исследовали влияние на миокард коротких (2 мин) периодов ишемии с последующим более длительным ограничением кровотока. Было установлено, что предшествующая ишемия способствовала более быстрому восстановлению функции ЛЖ после ИМ. Однако данная закономерность распространялась только на молодых и взрослых особей, у старых же масштаб поражения и последствия ИМ были более выраженными.
В клинических наблюдениях [69] у пациентов старшей возрастной группы вне зависимости от частоты и продолжительности эпизодов индуцируемой ишемии, кардиомиоциты сохраняли уязвимость к острой нехватке кислорода.
Так, P.Abete et al. [6] обнаружили, что у людей моложе 65 лет, отмечавших наличие стенокардии до развития ИМ, реже встречались кардиогенный шок, застойная СН и также была более низкя внутригоспитальная смертность по сравнению с группой лиц того же возраста без ангинозных приступов. После 65 лет наличие стенокардии до развития ИМ не способствовало снижению риска осложнений и смерти, что подтверждает снижение с возрастом адаптационных возможностей, в частности, миокарда [6].
Предполагают [6,44], что по мере старения в миокарде возникают изменения в строении и функционировании рецепторов, сигнальных систем и эффекторов, участвующих в формировании механизма прекондиционирования, что и приводит к снижению эффективности кардиопротекции.
Прекодиционирование и сопутствующая патология
Согласно данным литературы [14,29,45,48,53,57] при некоторых патологических состояниях и заболеваниях, таких как дислипидемия, атеросклероз, ожирение, метаболический синдром, сахарный диабет (СД), артериальная гипертензия (АГ) эффективность ишемического прекондиционирования может уменьшаться. Так, в эксперименте [34] и клинике [67] было установлено, что в условиях гипергликемии, обусловленной СД, ишемическое прекондиционирование не запускается или недостаточно выражено, чтобы обеспечивать защиту миокарда. Предполагают [64], что основным механизмом этого является вызванная гипергликемией дисфункция ферментов, ответственных за передачу сигнала на белки-эффекторы ионных каналов клеточной и митохондриальной мембран.
В то же время в литературе встречаются данные [50], свидетельствующие, что на ранних стадиях СД естественные кардиопротективные механизмы более активны, но этот адаптивный эффект быстро истощается, и миокард становится крайне чувствительным к ишемии, а феномен ишемического прекондиционирования не запускается.
Установлено [4], что сахароснижающие препараты, в частности, производные сульфонилмочевины, способны вызывать резистентность к прекондиционированию. Эти препараты закрывают КАТФ-каналы не только в поджелудочной железе (тем самым инициируя выброс инсулина и проявляя свое сахароснижающее действие), но и в сердце, блокируя защитный механизм ишемического прекондиционирования. Стоить отметить, что такая неизбирательность характерна не для всех производных сульфонилмочевины, а только для препаратов первого поколения. Препараты последующих генераций имеют более высокую селективность и гораздо меньше влияют на миокард.
При оценке влияния дислипидемии/ атеросклероза на феномен прекондиционирования, были получены различные данные [77]. С одной стороны, было устновлено негативное влияние гиперхолестеринемии на кардиопротекцию, с другой — независимость защитных механизмов от уровней липидов крови. Тем не менее, наиболее аргументированной остаётся точка зрения, подтверждающая снижение прекондиционирования при нарушения липидного обмена. Известно, что в состав мембраны кардиомиоцитов входят фосфолипиды, прешественники которых (липопротеиды высокой плотности) циркулируют в плазме и входят в состав общего липидного профиля. Поскольку мембрана принимает участие в передаче сигнала со специфических рецепторов, расположенных на её поверхности, нарушение её структуры по причине дефицита «строительного материала» снижает или полностью нивелирует [8] эффект прекондиционирования. Показано [70], что применение препаратов, снижающих уровень холестерина (статинов) приводит к повышению защитного потенциала миокарда.
Результаты изучения влияния АГ на исследуемый феномен также неоднозначны. Так, в ходе эксперимента [18] на гипертензивных крысах было установлено, что нормализация артериального давления (АД) приводила к увеличению эффективности ишемического прекондиционирования. Вместе с тем в другой экспериментальной работе [15] было показано, что ишемическое прекондиционирование сохраняло кардиопротекторный эффект у животных с АГ.
Основываясь на описанных выше данных можно сделать вывод, что наиболее у больных с сердечно-сосудистой патологией наиболее рационально активировать феномен прекондиционирования на фоне стабилизации показателей гемодинамики, показателей липидного и углеводного обмена.
Прекондиционирование и физические упражнения
Известно [55], что регулярная физическая активность является методом профилактики ишемического поражения сердца, снижает общий сердечно-сосудистый риск и выступает активатором метаболических процессов в миокарде. Во время выполнения привычных и легко переносимых упражнений повышается нагрузка на сердечную мышцу и, соответственно, возрастает её потребность в кислороде и энергетических субстратах. Возросшие потребности восполняются за счёт коронарной дилятации и интенсификации обменных процессов. Однако при увеличении нагрузки сверх переносимой возникает ишемия миокарда вследствие несоответствия между поставкой и потребностью в кислороде. Ишемия в свою очередь индуцирует высвобождение брадикинина, аденозина, монооксида азота, эндогенных опиоидов. Эти вещества активируя специфические сигнальные пути, готовят миокард к последующим, более длительным эпизодам ишемии, что, по сути, и представляет собой ишемическое прекондиционирование [7].
В эксперименте [30] на животных увеличение физической нагрузки приводило к открытию КАТФ-каналов митохондрий, повышению выработки антиоксидантного фермента — супероксиддисмутазы, Са2+-связывающих белков и других субстанций, препятствующих перегрузке Са2+ ишемизированных кардиомиоцитов и повреждению сердечной мышцы.
В исследовании [51] на животных была оценена роль физических нагрузок в защите ишемизированного и подвергшегося реперфузии миокарда от злокачественных желудочковых аритмий. У собак был смоделирован ИМ с последующей реперфузией, причём часть из них предварительно подверглась нагрузке на тредмиле в течении 21 мин с постепенным увеличением скорости и угла наклона дорожки. В результате, у животных, получивших нагрузку, число случаев возникновения жизнеопасных желудочковых аритмий оказалось существенно ниже, чем в контрольной группе. Одновременно с этим регистрировалось повышение содержания в ткани миокарда триггеров прекондиционирования, что подтвердило их участие в защите сердечной мышцы от ишемического повреждения.
Немаловажной является возможность восстановления с помощью физических нагрузок утраченной с возрастом восприимчивости к ишемическому прекондиционированию. В клинических условиях наилучшего эффекта в борьбе инволюцией защитных биомеханизмов миокарда у пациентов с ИБС удалось достичь с помощью применения регулярных физических нагрузок и низкокалорийной диеты. Причём раздельное применение физических упражнений или ограничения в калорийной пище оказалось далеко не так эффективно, как их комбинация [55].
Прекондиционирование и стволовые клетки
Говоря о различных вариантах кардиопротекции, следует упомянуть о стволовых клетках, введение которых в зону ишемического повреждения сердца приводило к воссозданию элементов мышечной и сосудистой ткани [84]. Они способны траснсформироваться в кардиомиоциты, гладкомышечные клетки стенок сосудов, клетки эндотелия и проводящей системы сердца. Вместе с тем, в первые сутки ИМ погибает 40% физиологического пула клеток-предшественников, что наносит практически невосполнимый ущерб резервным свойствам миокарда [21]. Кроме того, в условиях острой ишемии/аноксии резко снижается способность клеток к пролиферации и дифференцировке, а длительная ишемия препятствует интеграции трансплантированных в миокард стволовых клеток.
В связи с этим существует необходимость обеспечить защиту клеточных культур, пересаженных в поврежденный миокард, от факторов агрессии, в частности, от дефицита кислорода. Полагают [21], что одним из решений этой проблемы может быть ишемическое прекондиционирование донорских стволовых клеток перед их пересадкой.
Недавно в серии экспериментов на животных [80] было показано, что прерывистая гипоксия приводила к существенному повышению уровня выработки СХС-хемокина ростового фактора стволовой клетки 1 (SDF-1), вызывала возрастание миграционной активности клеток-прешественников за счёт увеличения на их поверхности количества рецепторов CXCR4. Кроме того, культивированные на протяжении 6 ч в гипоксических условиях стволовые клетки показали большую способность к дифференцировке в кардиомиоциты, эндотелиоциты и гладкомышечные клетки стенок сосудов, чем при адекватной доставке кислорода.
Антиапоптотический эффект мезенхимальных стволовых клеток также усиливается под влиянием прекондиционирования [22]. Так, стволовые клетки, подвергавшиеся эпизодам кратковременной гипоксии до введения, не только значительно ограничили зону ишемического повреждения миокарда лабораторных крыс в сравнении с контрольной группой, но и обладали более выраженным, по сравнению с обычными клетками, антиапоптотическим эффектом и способствовали увеличению жизнеспособной массы миокарда [10,21,24,31]. По всей видимости, указанные положительные сдвиги связаны с удлинением жизнеспособности стволовых клеток после их пересадки в ткань миокарда, что, соответственно, улучшает их адаптацию к новой среде.
Фармакологическое прекондиционирование
Результаты многочисленных исследований [27,43,65] показали, что существует ряд фармакологических препаратов, способных стимулировать и/или продлевать эффект ишемического прекондиционирования. В первую очередь он может быть достигнут с помощью аденозина, являющегося одним из основных триггеров физиологического прекондиционирования, и агонистов его рецепторов [38]. В сравнении с контрольной группой введение этого препарата ассоциировалось с увеличением фракции выброса ЛЖ, снижением количества неблагоприятных сердечно-сосудистых событий у пациентов со значительным атеросклеротическим поражением коронарных артерий [59,60].
Интересные результаты были получены в рамках исследования AMISTAD-II, в котором приняли участие более 2 тыс пациентов с острым ИМ. По данным сцинтиграфии с технецием 99m, введение аденозина в первые 15 мин от начала тромболитической терапии или непосредственно перед чрескожным коронарным вмешательством обеспечивало меньшие размеры зоны некроза. Причем действие аденозина было дозозависимым. В экспериментальной модели на животных аденозин показал способность восстанавливать утраченные защитные свойства ишемического прекондиционироваия и у пожилых особей.
В настоящее время на фармацевтическом рынке Украины присутствует отечественный препарат, содержащий аденозин-5΄-трифосфатоглюконато-магния (II) тринатриевую соль (Адвокард). Первые результаты применения адвокарда в нашей клинике говорят о перспективности его использования с целью кардиопротекции, основанной на феномене прекондиционирования.
Действуя на специфические опиоидные рецепторы кардиомиоцитов, ремифентанил (селективный агонист мю-опиоидных рецепторов) [33,76], морфин [20,39,42] и дельторфин II (специфический агонист дельта-рецепторов) [3] также способны ограничивать размеры ишемического некроза миокарда. В частности, в эксперименте на крысах Sun H.T. и Xue F.S. [66] установили значительное уменьшение зоны инфаркта и уровня МВ-фракции КФК в крови после введения ремифентанила.
Защитными свойствами обладают также ингаляционные анестетики севофлюран и изофлюран [26,62,82], применение которых сопровождается достоверным снижением уровня маркеров некроза миокарда и уменьшением числа реперфузионных злокачественных желудочковых аритмий. В эксперименте [65] на кроликах десфлюран инициировал процесс прекондиционирования, и уменьшал масштаб ишемической гибели сердечной мышцы. Считается [2], что наступающая под влиянием ингаляционных анестетиков толерантность кардиомиоцитов к гипоксии обусловлена снижением поступления кальция в клетки, сохранением энергетических субстратов, предупреждением развития апоптоза и торможением оксидативного стресса. Кроме того, под их влиянием происходит синтез белков, обладающих цитопротекторным эффектом, а именно антиоксидантных ферментов и протеинов, участвующих в стабилизации цитоскелета. Ингаляционные анестетики также повышают активность митохондриальных КАТФ-каналов. Прекондиционирование, вызываемое этими препаратами уменьшает выраженность постишемического нарушения контрактильности миокарда (миокардиального станнинга) и улучшает функцию эндотелия коронарных артерий. Однако, учитывая основную направленность действия этих препаратов, в клинической практике с целью активации собственно процессов прекондиционирования они не используются.
Никорандил, являющийся донатором оксида азота и относящийся к группе модуляторов калиевых каналов, повышая концентрацию NO , как рецептор-независимого триггера, и одновременно активируя КАТФ— каналы митохондрий, достоверно снижал риск развития ИМ с зубцом Q [25]. В других исследованиях [14,71] показано, что назначение никорандила пациентам с острым ИМ непосредственно перед интервенционным вмешательством на коронарных сосудах приводило к улучшению функции ЛЖ и снижало риск кардиальных осложнений. Этот эффект объясняется как сосудорасширяющими свойствами препарата и, соответственно, улучшением микроциркуляции в миокарде, так и стимулированием прекондиционирования [1].
Заслуживают внимания данные, указывающие на возможность повышения чувствительности миокарда больных СД к эффекту прекондиционирования с помощью никорандила. В исследовании, в котором принимали участие пожилые пациенты с ИБС, перенёсшие коронарную ангиопластику, была также установлена способность никорандила восстанавивать кардиопротективный эффект прекондиционирования [9]. В другой работе [72] было отмечено положительное влияние никорандила и на клеточные культуры стволовых клеток. Долгосрочное его назначение способствовало усилению их репаративного эффекта. Однако в последующем эффект ишемического прекондиционирования исчезал, вероятно, вследствие возникновения резистентности рецепторов КАТФ — каналов митохондрий. К тому же никорандил может вызывать язвы слизистых оболочек желудочно-кишечного тракта, что ограничивает его применение.
Способностью к открытию КАТФ-каналов обладает и периферический вазодилятатор диазоксид [40]. Открытие этих каналов вызывает выход ионов калия и гиперполяризацию мембраны гладкомышечных клеток сосудов, что нарушает функцию потенциалозависимых кальциевых каналов, снижает поступление внутрь клеток ионов кальция и перегрузку ими кардиомиоцитов. В эксперименте [5], когда диазоксид вводился лабораторным крысам, подвергшимся острой коронарной гипоксии, с последующей реперфузией, его применение ассоциировалось с уменьшением гиперконтрактуры кардиомиоцитов, возникшей на фоне восстановления кровотока. Данные о клиническом применении данного вещества отсутствуют.
Использование вальсартана при экспериментальном ИМ у крыс [78] сохраняло способность миокарда к прекондиционированию, что также приводило к уменьшению масштабов поражения миокарда при ИМ, сопровождалось более низкой концентрацией маркеров некроза кардиомиоцитов и провоспалительных медиаторов по сравнению с контрольной группой.
Не исключено, что кардиопротекторные свойства левосимендана [47] и других фармакологических агентов, в частности статинов [70], в определённой степени также обусловлены эффектом прекондиционирования.
Таким образом, результаты многочисленных экспериментальных и клинических исследований свидетельствуют о высокой эффективности прекондиционирования в предупреждении ишемического повреждения миокарда. Наиболее физиологическим методом прекондиционирования миокарда у больных ИБС являются физические тренировки. Однако их применение часто ограничено наличием у больных сопутствующих патологий. Поэтому использование фармакологических препаратов для инициации данного феномена является альтернативой для таких пациентов. К тому же фармакологическое прекондиционирование можно сочетать с физическими тренировками, что повысит безопасность их проведения. Таким образом, применение фармакологических препаратов с целью развития прекондиционирования позволит существенно улучшить не только лечение, но и вторичную профилактику ИБС.
Литература
1. Бадриддинова Л. Ю., Юргель Н. В., Павлова Л. И. и др. Эффективность и безопасность никорандила у больных стабильной стенокардией // Фарматека : медицинский журнал. — 2009 — № 8 . — С. 65-68.
- Князькова Л.Г., Постнов В.Г., Ломиворотов В.В. и др. Феномен прекондиционирования в кардиохирургии // Патология кровообращения и кардиохирургия — 2010 — № 3 — С. 11-13.
- Маслов Л.Н., Барзах Е.И., Крылатов А.В и др. Опиоидный пептид дельторфин II имитирует кардиопротекторный эффект ишемического прекондиционирования: роль d2-опиоидных рецепторов, протеинкиназы С, КАТФ-каналов // Бюллетень экспериментальной биологии и медицины — 2010. — № 5 — С. 524.
- Старенькая И., Сахарный диабет и феномен закаливания тканей миокарда ишемией //Здоров'я України. — 2004. — №96 — С. 41-42.
- Abdallah Y., Wolf C., Meuter K. Preconditioning with diazoxide prevents reoxygenation-induced rigor-type hypercontracture // J Mol Cell Cardiol. — 2010. — Vol. 48. — P. 270-276.
- Abete P, Rengo F. Ischemic preconditioning in the aging heart: from bench to bedside // Ageing Res Rev.— 2010. — Vol. 9. — P. 153-162.
- Ágnes V., J.R. Parratt. A common mechanism in the protective effects of preconditioning, cardiac pacing and physical exercise against ischemia and reperfusion-induced arrhythmias // Exp Clin Cardiol. — 2005. — Vol. 10. — P. 200-205.
- Alberts et al. // Molecular Biology of the Cell, Third edition. Garland Publishing. — 1994. — Vol. 10. — P. 477.
- Barua A., Standen N.B., Galiñanes M. Modulation of the Nitric Oxide Metabolism Overcomes the Unresponsiveness of the Diabetic Human Myocardium to Protection Against Ischemic Injury // J Surg Res. — 2010. — Vol. 15. — P. 22.
- Chacko S.M., Ahmed S. Hypoxic preconditioning induces the expression of pro-survival and pro-angiogenic markers in mesenchymal stem cells // Am J Physiol Cell Physiol — 2010. — Vol. 299. — P. 1562 — 1570.
- Chevion M, Leibowitz S, Aye N.N. et al. Heart protection by ischemic preconditioning: a novel pathway initiated by iron and mediated by ferritin // J Mol Cell Cardiol. — 2008. — Vol. 45. — P. 839-845.
- Cohen M.V., Liu G.S., Downey J.M. Preconditioning causes improved wall motion as well as smaller infarcts after transient coronary occlusion in rabbits // Circulation — 1991. — Vol. 84. — P. 341-349.
- Cohen M.V., Yang X.M. Cardioprotective PKG- independent NO signaling at reperfusion // Am J Physiol Heart Circ Physiol. — 2010. — Vol. 299. — P. 2028-2036.
- Cokkinos D.V., Pantos С. Myocardial protection in man — from research concept to clinical practice // Heart Fail Rev. — 2007. — Vol. 12. — P. 345-362.
- Dai W., Simkhovich B.Z., Kloner R.A. Ischemic preconditioning maintains cardioprotection in aging normotensive and spontaneously hypertensive rats // Exp Gerontol. — 2009. — Vol. 44. — P. 344-349.
- Diaz R.J., Hinek A., Wilson G.J. Direct evidence of chloride ion efflux in ischaemic and pharmacological preconditioning of cultured cardiomyocytes // Cardiovasc Res. — 2010.- Vol. 87. — P.545-551.
- D. Th. Kremastinos. The Phenomenon of Preconditioning Today // Hellenic J Cardiol. — 2005. — Vol. 46. — P. 1-4.
- Ebrahim Z., Yellon D.M., Baxter G.F. Ischemic preconditioning is lost in aging hypertensive rat heart: independent effects of aging and longstanding hypertension // Exp Gerontol. — 2007. — Vol.42. — P. 807-814.
- Fan W.J., van Vuuren D., Genade S., Lochner A. Kinases and phosphatases in ischaemic preconditioning: a re-evaluation // Basic Res Cardiol. — 2010. — Vol. 105. — P. 495-511.
- Frässdorf J ., Huhn R., Niersmann C., Weber N.C. Morphine induces preconditioning via activation of mitochondrial K(Ca) channels // Can J Anaesth. — 2010. — Vol. 57. — P. 767-773.
- Haider H.Kh., Ashraf M. Preconditioning and stem cell survival // J Cardiovasc Transl Res. — 2010. — Vol. 3. — P. 89-102.
- He A., Jiang Y., Gui C. et al. The antiapoptotic effect of mesenchymal stem cell transplantation on ischemic myocardium is enhanced by anoxic preconditioning // Can J Cardiol. — 2009. — Vol. 25. — P. 353-358.
- Headrick J.P., Lasley R.D. Adenosine receptors and reperfusion injury of the heart // Handb Exp Pharmacol . — 2009. — Vol. 193. — P. 189-214.
- Нerrmann J.L., Abarbanell A.M., Weil B.R. Optimizing Stem Cell Function for the Treatment of Ischemic Heart Disease // J Surg Res. — 2010. — Vol. 161. — P. 173.
- Horinaka S., Yabe A., Yagi H. et al. Effects of nicorandil on cardiovascular events in patients with coronary artery disease in the Japanese Coronary Artery Disease (JCAD) study // Circ J. — 2010. — Vol. 74. — P. 503-509.
- Hu Z.Y., Liu J. Mechanism of cardiac preconditioning with volatile anesthetics // Anaesth Intensive Care. — 2009. — Vol. 37. — P. 532-538.
- Iliodromitis E.K., Cokkinos P., Zoga A. et al. Oral nicorandil recaptures the waned protection from preconditioning in vivo // Br J Pharmacol. — 2003. — Vol. 138. — P. 1101-1106.
- Ishihara M., Sato H., Tateishi H. et al. Implications of prodromal angina pectoris in anterior wall acute myocardial infarction: acute angiographic findings and long-term prognosis // JAm Coll Cardiol. — 1997. — Vol. 30. — P. 970-975.
- John Peart., Headrick J. Clinical cardioprotection and the value of conditioning responses // Am J Physiol Heart Circ Physiol. — 2009- Vol. 296. — P. 1705-1720.
- Jeremy French., Hamilton K.L. Exercise-induced protection against myocardial apoptosis and necrosis: MnSOD, calcium-handling proteins, and calpain // FASEB J. — 2008. — Vol. 22. — P. 2862-2871.
- Kamota T., Li T.S., Morikage N. et al. Ischemic pre-conditioning enhances the mobilization and recruitment of bone marrow stem cells to protect against ischemia/reperfusion injury in the late phase // J Am Coll Cardiol. — 2009. — Vol. 53. — P. 1814-1822.
- Kawada T., Akiyama T., Shimizu S. et al. Detection of endogenous acetylcholine release during brief ischemia in the rabbit ventricle: a possible trigger for ischemic preconditioning // Life Sci. — 2009. — Vol. 85. — P. 597-601.
- Kim H.S., Cho J.E., Hong S.W. et al. Remifentanil protects myocardium through activation of anti-apoptotic pathways of survival in ischemia-reperfused rat heart // Physiol Res. — 2010. — Vol. 59. — P. 347-356.
- Kim H.S., Cho J.E., Hwang K.C. et al. Diabetes mellitus mitigates cardioprotective effects of remifentanil preconditioning in ischemia-reperfused rat heart in association with anti-apoptotic pathways of survival // Eur J Pharmacol. — 2010. — Vol. 628. — P. 132-139.
- Kloner R.A., Shook T., Przyklenk K. et al. Previous angina alters in-hospital outcome in TIMI 4. A clinical correlate to preconditioning? // Circulation. — 1995. — Vol. 91. — P. 37-45.
- Kondo-Nakamura M ., Shintani-Ishida K., Uemura K. et al. Brief exposure to carbon monoxide preconditions cardiomyogenic cells against apoptosis in ischemia-reperfusion // Biochem Biophys Res Commun. — 2010. — Vol. 393. — P. 449-454.
- Lange R., Ingwall J., Hale S.L. Preservation of high-energy phosphates by verapamil in reperfused myocardium // Circulation. — 1984. — Vol. 70. — P. 734-741.
- Lavi S, Lavi R. Conditioning of the heart: From pharmacological interventions to local and remote protection. Possible implications for clinical practice // Int J Cardiol. — 2010. — Vol. 146. — P. 311- 318.
- Li R., Wong G.T., Wong T.M. et al. Intrathecal morphine preconditioning induces cardioprotection via activation of delta, kappa, and mu opioid receptors in rats // Anesth Analg. — 2009. — Vol. 108. — P. 23-29.
- Lisa Schwartz, Reimer K.A. Pharmacological preconditioning with diazoxide slows energy metabolism during sustained ischemia // Exp Clin Cardiol. — 2007. — Vol. 12. — P. 139-147.
- Lishmanov I.B., Maslov L.N., Khaliulin I.G. et al. Role of heat shock proteins, aldose reductase, Bcl-2 protein and microRNA in the mechanism of delayed preconditioning of heart // Ross Fiziol Zh Im I M Sechenova. — 2010. — Vol. 96. — P. 472-488.
- Lu Xh., Ran K., Xu Jm. Preconditioning of morphine protects rabbit myocardium from ischemia-reperfusion injury // Zhejiang Da Xue Xue Bao Yi Xue Ban. — 2009. — Vol. 38. — P. 399-403.
- Mahaffey K.W., Puma J.A., Barbagelata A. et al. For the AMISTAD Investigators: Adenosine as an adjunct to thrombolytic therapy for acute myocardial infarction // J Am Coll — 1999. — Vol. 34. — P. 1711-1720.
- Loubani M. The aging human myocardium: tolerance to ischemia and responsiveness to ischemic preconditioning // J Thorac Cardiovasc Surg. — 2003. — Vol. 126. — P. 143-147.
- Masaharu Ishihara. Diabetes mellitus prevents ischemic preconditioning in patients with a first acute anterior wall myocardial infarction // J Am Coll Cardiol. — 2001. — Vol. 38. — P. 1007-1011.
- Matsuzaki S., Szweda P.A., Szweda L.I. et al. Regulated production of free radicals by the mitochondrial electron transport chain: Cardiac ischemic preconditioning // Adv Drug Deliv Rev. — 2009. — Vol. 61. — P. 1324-1331.
- Meyer K., Schipke J.D. Inotropic, vasodilating and preconditioning actions of levosimendan in the heart // Thorac Cardiovasc Surg. — 2008. — Vol. 56. — P. 379-385.
- Michael Randall. Enhanced cardiac preconditioning in the isolated heart of the transgenic ((mREN-2)27) hypertensive rat // Cardiovascular Research. — 1997. — Vol. 33. — P. 400-409.
- Murry C.E., Jennings R.B., Reimer K.A. Preconditioning with ischemia: A delay of lethal cell injury in ischemic myocardium // Circulation. — 1986. — Vol. 74. — P. 1124-1136.
- Pantos C., Mourouzis I. Protection of the abnormal heart // Heart Fail Rev. — 2007. — Vol. 12. — P. 319-330.
- Parra V.M., Macho P., Domenech R.J. Late Cardiac Preconditioning by Exercise in Dogs is Mediated by Mitochondrial Potassium Channels // J Cardiovasc Pharmacol. — 2010. — Vol. 56. — P. 268- 274.
- Pete Abete. Clinical Application of Ischemic Preconditioning in the Elderly // Dose Response. — 2010. — Vol. 8. — P. 34-40.
- Prasad V. Myocardial preconditioning against ischemia-reperfusion injury is abolished in Zucker obese rats with insulin resistance // Am J Physiol Regul Integr Comp Physiol. — 2007. — Vol. 292. — P. 920-926.
- Przyklenk K., Kloner R.A. Ischemic preconditioning: exploring the paradox // Progr Cardiovasc Disease. — 1998. — Vol. 40. — P. 517-547.
- R. Domenech Preconditioning: A New Concept About the Benefit of Exercise // Circulation. — 2006. — Vol. 113. — P. 1-3.
- R. Fenton Aging Reduces the Cardioprotective Effect of Ischemic Preconditioning in the Rat Heart // Journal of Molecular and Cellular Cardiology. — 2000. — Vol. 32. — P. 1371-1375.
- R. Wan, Camandola S. Intermittent Food Deprivation Improves Cardiovascular and Neuroendocrine Responses to Stress in Rats. The American Society for Nutritional Sciences // J. Nutr. — 2003. — Vol. 133. — P. 1921-1929.
- Sadat U. Signaling pathways of cardioprotective ischemic preconditioning // Int J Surg. — 2009. — Vol. 7. — P. 490- 498.
- Sadigh B., Quintana M., Sylvén C., Berglund M. The ischemic preconditioning effect of adenosine in patients with ischemic heart disease // Cardiovasc Ultrasound. — 2010. -Vol. 7. — P. 52.
- Sadigh B, Shahgaldi K, Sylvén C. Preconditioning effects of adenosine in patients with severe coronary artery disease but preserved coronary flow reserve // Coron Artery Dis. — 2009. — Vol. 20. — P. 354-359.
- Sean Davidson. Signalling via the reperfusion injury signalling kinase (RISK) pathway links closure of the mitochondrial permeability transition pore to cardioprotection // The International Journal of Biochemistry & Cell Biology. — 2006. — Vol. 38. — P. 414-419.
- Sepac A, Sedlic F. Isoflurane preconditioning elicits competent endogenous mechanisms of protection from oxidative stress in cardiomyocytes derived from human embryonic stem cells // Anesthesiology. — 2010. — Vol. 113. — P. 906-916.
- Sheik Wisel, Khan M., Lakshmi K.M. et al. Pharmacological Preconditioning of Mesenchymal Stem Cells with Trimetazidine (1-[2,3,4-Trimethoxybenzyl]piperazine) Protects Hypoxic Cells against Oxidative Stress and Enhances Recovery of Myocardial Function in Infarcted Heart through Bcl-2 Expression // J Pharmacol Exp Ther. — 2009. — Vol. 329. — P. 543-550.
- Sivaraman V., Hausenloy D.J., Wynne A.M. et al. Preconditioning the diabetic human myocardium // J Cell Mol Med . — 2010. — Vol. 14. — P. 1740-1746.
- Smul T.M., Redel A., Stumpner J. et al. Time course of desflurane-induced preconditioning in rabbits //J Cardiothorac VascAnesth. — 2010. — Vol. 24. — P. 91-98.
- Sun H.T., Xue F.S., Liu K.P. et al. Effect of remifentanil preconditioning on myocardial ischemia-reperfusion injury // Zhongguo Yi Xue Ke Xue Yuan Xue Bao. — 2009. — Vol. 31. — P. 612-615.
- Takahashi Т. Acute hyperglycaemia prevents the protective effect of pre- infarction angina on microvascular function after primary angioplasty for acute myocardial infarction // Heart. — 2008. — Vol. 94. — P. 1402-1406.
- Talukder M.A., Yang F., Shimokawa H. et al. eNOS is required for acute in vivo ischemic preconditioning of the heart: effects of ischemic duration and sex // Am J Physiol Heart Circ Physiol. — 2010. — Vol. 299. — P. 437-445.
- Tani et al. Dysfunctional ischemic preconditioning mechanisms in aging // Cardiovascular Research. — 2001. — Vol. 49. — P. 11-14.
- Thuc L.C., Teshima Y., Takahashi N. Mitochondrial K(ATP) channels-derived reactive oxygen species activate pro-survival pathway in pravastatin-induced cardioprotection // Apoptosis. — 2010. — Vol. 15. — P. 669-678.
- Trezkalla S.H., Kloner R.A. Preconditioning in humans // Heart Fail Rev. — 2007. — Vol. 12. — P. 201-206.
- Vien Khach Lai, Galiñanes M. Protection of Human Myocardium by Bone Marrow Cells: Role of Long-Term Administration of the Mitochondrial KATP Channel Opener Nicorandil // Journal of Surgical Research. — 2010. — Vol. 45. — P. 339-350 .
- Wang J.A., He A., Hu X., Jiang Y. et al. Anoxic preconditioning: a way to enhance the cardioprotection of mesenchymal stem cells // Int J Cardiol. — 2009. — Vol. 133. — P. 410-412.
- Wei H., Vander Heide R.S . Ischemic preconditioning and heat shock activate Akt via a focal adhesion kinase-mediated pathway in Langendorff-perfused adult rat hearts // Am J Physiol Heart Circ Physiol. — 2010. — Vol. 298. — P. 152-157.
- Wong G.T., Ling Ling J., Irwin M.G. Activation of central opioid receptors induces cardioprotection against ischemia-reperfusion injury // Anesth Analg. — 2010. — Vol. 111. — P. 24-28.
- Xu Z.D., Jin M., He W.X. Remifentanil preconditioning lowers cardiac troponin I levels in patients undergoing off-pump coronary artery bypass graft surgery // Nan Fang Yi Ke Da Xue Xue Bao. — 2009. — Vol. 29. — P. 1554-155 6.
- Yadav H.N., Singh M., Sharma P.L. Modulation of the cardioprotective effect of ischemic preconditioning in hyperlipidaemic rat heart // Eur J Pharmacol. — 2010. — Vol. 643. — P. 78-83.
- Yang J. Valsartan preconditioning protects against myocardial ischemia- reperfusion injury through TLR4/NF-kappaB signaling pathway // Mol Cell Biochem. — 2009. — Vol. 330. — P. 39-46.
- Yang X, Cohen M.V., Downey J.M. Mechanism of Cardioprotection by Early Ischemic Preconditioning // Cardiovasc Drugs Ther. — 2010. — Vol. 29. — P.30-32.
- Yao L., Hypoxic Preconditioning Enhances the Benefit of Cardiac Progenitor-Cell Therapy for Treatment of Myocardial Infarction by Inducing CXCR4 Expression // Circ Res. — 2009. — Vol. 104. — P. 1209-1216.
- Yon H.S., Cardioprotection and ageing // Korean J Anesthesiol. — 2010. — Vol. 58. — P. 223-230.
- Zadorozhny M.V., Iavorovski A.G. Method of pharmacological myocardial preconditioning with halogen-containing anesthetics in cardiosurgical patients // Anesteziol Reanimatol. — 2008. — Vol. 5. — P. 4-8.
- Zhu J., Rebecchi M.J. Age-associated differences in activation of Akt/GSK-3beta signaling pathways and inhibition of mitochondrial permeability transition pore opening in the rat heart // J Gerontol A Biol Sci Med Sci . — 2010. — Vol. 65. — P. 611-619.
- Zeiher A. et al. Stem cell therapy of cardiac disease: an update // Nephrology Dialysis Transplantation. — 2004. — Vol. 19. — P. 1673-1677.
The phenomenon of preconditioning
Donetsk National Medical University named by M. Gorkiy
Institute of Urgent and Reconstructive Surgery named by V.K. Gusak AMS of Ukraine, Donetsk
This review presents recent data of literature on the mechanisms of ischemic preconditioning in normal and pathological conditions
(dyslipidemia, atherosclerosis, obesity, metabolic syndrome, diabetes mellitus, hypertension). We examined the impact of age and physical
activity on protection of the myocardium from ischemic injury. Separately we pointed at drugs that have the properties of inductors of ischemic
preconditioning. The data on the positive impact of this phenomenon on the stem cell treatment is also published in this review.
Key words: ischemic
preconditioning
Ватутин Николай Тихонович — заведующий кафедрой госпитальной терапии
Донецкого государственного медицинского университета, д.мед.н., профессор;
г.Донецк, 83003, ул. Калужская 32/33, домашний телефон (0622) 94-88-82, рабочий
телефон (0622) 61-99-96, т/ф (062) 385-05-17.
Колесников Вадим Сергеевич — г. Донецк 83045, ул. Кирова 36а/22, домашний телефон (0622) 66-23-95, моб. 066-898-34-62 e—mail: kolesnikovVS@mail. ru